一、产品定位
早前,肿瘤免疫治疗大多作为三大疗法之后才考虑的辅助治疗方案,用于维持肿瘤稳定,降低放化疗的副作用。随着研究和临床试验的深入,目前临床上大多将免疫疗法联合药物治疗,改善患者免疫功能,清楚肿瘤微小残留,延长总生存期。越来越多的临床试验结果证明,免疫治疗联合用药与传统药物相比对肿瘤存活率的提高约达一倍之余。随着研究的进展、技术的成熟,很多专家认为,“免疫治疗+”是未来肿瘤治疗的趋势,目前已经有部分临床试验采取联合使用多种免疫疗法的方案,例如治疗性肿瘤疫苗与免疫检查点单抗联合用药,CAR-T疗法与免疫检查点单抗联合使用等。未来,配合基因或蛋白水平的检测也将深入参与试验,以保证治疗的准确性。
本公司采用的GAMMA-T细胞是人外周血中存在的另外一类T淋巴细胞,与现在使用的CAR-T疗法的T细胞相比,该类细胞可以用于异体输注,不产生移植排斥反应,结合CAR技术可以解决肿瘤免疫细胞治疗产品的通用性问题和细胞种子库问题,节约成本和缩短病人治疗时细胞制备窗口期。
二、遵循标准
 项目产品开发所遵循的现有业界技术标准:
项目产品开发所遵循的现有业界技术标准:
《细胞治疗产品研究与评价技术指导原则(试行)》
《中华人民共和国药典》卫生部化学、生化、抗生素药品第一分册
GMP生产质量管理规范
卫办医政发(2012)135号
《医疗技术临床应用管理办法》
《国家卫生计生委关于取消第三类医疗技术临床引用准入审批有 关工作的通知》
《自体免疫细胞(T细胞、NK细胞)治疗技术管理规范》
三、技术介绍
第一部分 自体免疫细胞治疗技术的范畴
自体免疫细胞治疗技术:从自体外周血中分离的单个核细胞经过体外激活和扩增后输入患者体内,直接杀伤肿瘤细胞或病毒感染细胞,或调节 和增强机体的免疫功能。这类细胞免疫治疗技术主要包括:
一. 自体CIK细胞(自体细胞因子诱导的杀伤细胞)
二. 自体TIL细胞(自体肿瘤浸润淋巴细胞)
三. 自体DC-CIK细胞(自体树突状细胞刺激的CIK细胞)
四. 自体CTL细胞(细胞毒T淋巴细胞)
五. 自体γδT细胞 (自体伽马德尔塔T细胞)
六. 自体NK细胞(自然杀伤细胞)
第二部分 自体免疫细胞治疗技术临床应用机构要求
一、临床应用机构基本要求
(一)开展自体免疫细胞治疗技术应当与该医疗机构功能、任务相适应。
(二)具有卫生部门核准登记的三级甲等医院或省级及省级以上专科医院。
(三)具有与免疫细胞治疗相关的科室。科室人员组成包括有从事人体免疫细胞治疗相适应的执业医师、执业护士、具有免疫学专业背景的专家和免疫细胞制备技术人员。该科室职责包括接受体细胞免疫治疗患者的选择,治疗方案的制定,患者的管理和随访,疗效评估体系的建立,规范治疗的程序建立,以及在治疗过程中处理可能出现的问题等。具备从事体细胞治疗质量控制的专业检验科室和人员。
(四)具有人体免疫细胞治疗所需要的场地、设备和设施。
(五)医院设有管理规范、运作正常的临床伦理委员会,该委员会中从事人体细胞免疫治疗的相关人员不超过委员人数的1/4。
二、从事自体免疫细胞治疗技术的人员基本要求
 (一)免疫细胞治疗临床医师
(一)免疫细胞治疗临床医师
1. 从事免疫细胞治疗的临床医师应取得《执业医师证书》、有5年以上相关临床诊疗工作经验。负责人应具有副主任医师及以上专业技术职务,主管医师应具有主治医师及以上专业技术职务任职资格。
2.掌握了人体体细胞免疫的基本原理,并经卫生部指定免疫细胞治疗技术培训机构培训,并取得上岗资格。
(二)自体免疫细胞制备实验室人员
1.制备自体免疫细胞实验室至少有1名具有医学、免疫或生物专业背景的高级职称人员担任负责人,且能对细胞制备和质量管理中的实际问题作出正确判断和处理,并能根据免疫细胞的生物学特性与临床医师沟通制定适合患者的免疫细胞治疗方案。
2.从事细胞制备工艺的操作人员应具有相关专业(生物、免疫、检验和医学)大学(专)本科及以上学历,经卫生部指定的专业体细胞制备技术培训,并取得上岗证书。
第三部分 自体免疫细胞制剂制备和质量控制要求
一、具有体外操作过程的细胞培养成分和添加物(培养液、细胞因子、血清等)以及制备过程所用耗材的来源和质量认证,应符合临床使用的质量要求,原则上鼓励采用无血清培养基、自体血清或者自体血浆。不允许使用异种血清或者血浆。
二、自体免疫细胞治疗产品的质控标准
(一).每批体细胞的检定
(1)细胞数量和存活率:细胞数量应满足临床最低需求,存活率应不低于80%。
(2)每批细胞来源的确认:应注明来源并加以标记或确定批号。
(3)无菌试验:每批培养的体细胞在患者输注前均应进行无菌试验。建议在培养开始后3~4天起每间隔一定时间取培养液样品,包括患者回输前48小时取样,按现行版《中国药典》生物制品无菌试验规程进行。在患者使用前,取培养液及/或沉淀物用丫啶橙染色或革兰染色,追加一次污染检测。
进行长期培养的体细胞,应进行支原体检查。对每一批体细胞终制剂应留样检测。如果留样发现阳性结果或发现几次阳性结果后,应及时对生产过程进行检查。如果在体细胞制备的早期发现有污染的情况,应终止该批体细胞制品的继续制备。
(4)体细胞的纯度与均一性
在体细胞回输前,应证明其纯度和均一性已达到临床应用水平。
(5)生物学效应
如有可能,应尽量检测每批体细胞的生物学效应,例如体细胞具有的某种生物学功能,分泌某种产物的能力,表达某种标志的水平等。
(二).体细胞制品外源因子的检测包括:细菌、真菌、支原体和内毒素。参照现行版《中国药典》生物制品相关规程进行。
三.从事体细胞制剂机构应具有自体免疫细胞制备及检定过程的原始记录和检定报告。永久保留。
第四部分 自体免疫细胞制剂制备工艺流程
在抗癌战役中,免疫系统有两个不利条件。一是免疫系统不会攻击自身组织,而肿瘤细胞并非外来之物,是正常细胞癌变产生的,所以免疫细胞很难区分肿瘤细胞和正常细胞。二是即使被发现,许多肿瘤细胞也会使用一些伎俩,阻止免疫细胞向它们开火。肿瘤细胞非常狡猾,已经学会逃脱免疫细胞的追捕,并干扰免疫细胞的进攻。
为避免误伤正常组织,免疫系统演化出了一套保护机制,只有确认癌细胞表面存在两种分子时,T细胞才会开火。第一种是MHC(majoy histocompatibility complex,主要组织相容性复合体)分子,一种大的蛋白络合物,主要功能是绑定由病原体衍生的肽链(即抗原,也就是树突状细胞“呈递”给T细胞的靶标)。另一种是向T细胞发送信号,告诉T细胞开始攻击的共刺激配体(co-stimulatory ligand)。如果没有同时检测到这两种分子,T细胞就会放行。因此,癌细胞至少有两种可以骗过免疫细胞,逃避免疫攻击的伎俩:停止在细胞表面表达MHC分子,或表达另一种能向T细胞发送停火信号的共刺激配体。
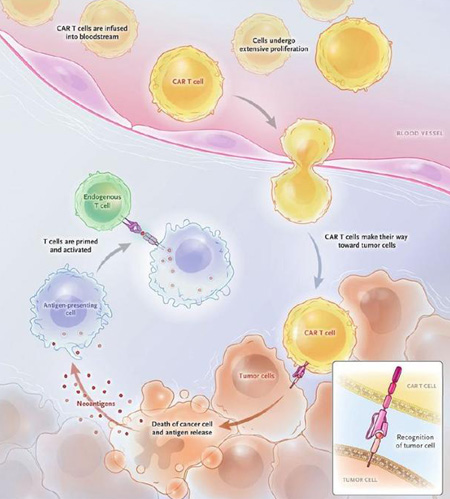
CAR-T细胞治疗具体来看主要分为5个步骤:
1. 从癌症患者外周血中分离出T细胞
2. T细胞激活利用基因工程将能特意识别肿瘤细胞的CAR结构转入T细胞
3. 利用基因工程将能特意识别肿瘤细胞的CAR结构转入T细胞
4. 体外培养,大量扩增CAR-T细胞至治疗所需剂量,一般为十亿至百亿级别
5. 化疗清淋预处理
6. 回输CAR-T细胞,观察疗效病严密监测不良反应。